|
Tlahui - Medic No. 32, II/2011

Evaluación mediante antibiogramas del efecto de la quina amarilla (Hintonia latiflora (Sesse et Moc.ex.DC) Bullock), cuachalalate (Hypopterygium adstringens Schltdl.), estafiate (Artemisia ludoviciana ssp. mexicana (Willd. ex Spreng.) Keck), eucalipto (Eucalyptus camaldulensis Dehn.), y tomillo (Thymus vulgaris L.), en cepa patógena de Escherichia coli.
Estudiantes: María Esperanza Martínez Espinosa; y María del Carmen Claudia Serrano Pérez
Colaboradores: QFB Edith Patricia Orea Esparza; y el Ing. Quím. José Roberto Carrasco Villegas.
Profesor: Dr. Mario Rojas Alba
Cuautla, Morelos, México, Marzo del 2011
Medicina Tradicional.
Escuela de Enfermería
Universidad Autónoma del Estado de Morelos
Convenio académico con Tlahui-Educa
Resumen
Se realizó un estudio sobre el efecto que tiene la quina amarilla (Hintonia
latiflora (Sesse et Moc.ex.DC) Bullock), cuachalalate (Hypopterygium adstringens
Schltdl.), estafiate (Artemisia ludoviciana ssp. mexicana (Willd. ex Spreng.)
Keck), eucalipto (Eucalyptus camaldulensis Dehn.), y tomillo (Thymus vulgaris
L.). Sobre una cepa de Escherichia coli, mediante pruebas para el análisis
clínico bacteriológico de las mismas, en el laboratorio CEDMAA (Centro de de
Diagnostico Microbiológico de Aguas y Alimentos). Se pretendía identificar el
grado de esterilidad del papel filtro impregnado de los extractos hidroalcoholados que se utilizaran como antibiogramas y si existía algún efecto
inhibitorio de las plantas en cuestión sobre dichas cepas; todo esto mediante
estudios experimentales de laboratorio.
Se utilizan dos tipos de técnicas para la elaboración de los extractos
hidroalcoholados, una en donde se impregna el papel filtro hirviendo el extracto
con estos y la otra en donde al extracto se le agrega mas planta de cada una de
las especies botánicas de estudio y se deja consumir a fuego lento. Después se
realizó la prueba de esterilidad de todos los discos de papel filtro Whatman de
3 cm, impregnados con los extractos hidroalcoholados de las plantas de estudio,
sembrando los discos en agar sangre y teniendo una caja Petri con agar sangre,
como control del área en donde se sembró para poder identificar si estaba libre
de gérmenes patógenos. Posteriormente se procedió a realizar la prueba de género
y especie de la bacteria de E. coli, para asegurarnos de la identidad de
la
bacteria y no se utilizara la incorrecta. Una vez teniendo estas dos pruebas se
realizó la siembra de la bacteria E. coli en un medio de cultivo con agar Muller
Hinton, donde se colocan los discos de papel filtro Whatman de 3 cm impregnados
de los extractos hidroalcoholados con las plantas de estudio, y los discos de
control con los antibióticos siguientes: nitrofurantoina, netilmicina,
cefotaxima, trimetropim sulfameroxazol, ampicilina, ceftriaxona, carbenicilina,
amikacina, gentamicina y cloranfenicol, a fin de realizar las comparaciones
correspondientes. En este estudio solo se observaron efectos de inhibición en
las caja Petri con los antibióticos de control, ya que en los caso de las
pruebas realizadas con los extractos hidroalcoholados de las plantas de estudio
se presentó un crecimiento bacteriano, considerándolo como normal, solo
se presentaron algunos cambios de coloración en el medio de cultivo. Se puede
decir que a pesar de utilizar una buena
técnica de esterilidad en la elaboración de los extractos hidroalcoholados y en
la impregnación del papel filtro Whatman 6 y la implementación de técnicas de
asepsia y antisepsia, no se obtuvo lo que se esperaba, considerando que esas
especies botánicas no tienen efecto bactericida en la ceba de E. coli, o que el
grado de concentración de las especies botánicas utilizadas para la elaboración
de los extractos hidroalcoholados no fue el adecuado para poder presentar
efectos inhibitorios sobre la bacteria.
INTRODUCCIÓN
La resistencia de algunas poblaciones microbianas a distintos antimicrobianos es
en la actualidad un grave problema que enfrenta la práctica médica moderna,
aspecto que adquiere matices alarmantes y dramáticos cuando se trata de
infecciones del tracto gastrointestinal. Sobre este particular, se puede afirmar
que los errores en la prescripción, administración y uso inadecuado de tales
medicamentos han influido de forma conjunta para aumentar su alarmante
incidencia en el mundo.
Este problema de salud desencadena una serie de acciones concretas en la
comunidad científica internacional, dirigidas no sólo a identificar posibles
factores de riesgos, o desarrollar nuevas prácticas que garanticen el uso
adecuado y racional de estos medicamentos para disminuir los eventos de
resistencia antimicrobiana y aumentar la seguridad del paciente, sino también a
buscar, quizás como nunca antes, nuevos compuestos tóxicos para la célula
microbiana, en especial aquellas que son de importancia clínica.
Sobre este último aspecto, existen en nuestro continente y en otras partes del
mundo muchos ejemplos que demuestran el interés científico existente, por
descubrir estos compuestos a partir de organismos vegetales. Tal preferencia,
obedece a que éstos contienen en sus raíces, tallos, hojas, flores y frutos
muchos principios activos, que se sinergizan unos a otros, atacando por
diferentes vías a los microorganismos y, al hacerlo, al mismo tiempo dificultan
el desarrollo de resistencia hacia tantos compuestos. En este contexto, la
medicina tradicional practicada y transmitida por los habitantes de una zona
geográfica determinada es, sin duda, una fuente primaria muy importante de
información para identificar nuevas plantas candidatas a medicamentos
fitoterapéuticos o portadoras de compuestos químicos específicos con actividad
terapéutica.
La sabiduría popular en estos casos no es suficiente, se requiere además tener
un respaldo científico adecuado que permita demostrar, o que contribuya a
probar, las potencialidades toxicológicas sobre las células microbianas. (1)
MARCO TEÓRICO
Antecedentes
No sabemos quien utilizó las plantas por primera vez, pero alguien y más
probablemente muchos pueblos diferentes descubrieron en los primeros albores de
la historia que algunas plantas son buenas para comer y otras tienen propiedades
curativas, sobre todo para cuando se presenta algún tipo de infección que es
difícil de combatir con algunos antibióticos o que estos no son prescritos
correctamente, o en algunos de los casos nos pueden producir alguna otra
alteración en el cuerpo humano.
Seguramente la búsqueda de algún remedio fue algo que se dio en todas las
culturas a la vez, fruto del deseo del hombre de sanar, por cuestión
mágica-religiosa o de algún preparado que le proporcionase una mayor felicidad
temporal. La mayoría de las veces los descubrimientos fueron simplemente
resultado de la búsqueda de nuevos alimentos. Los antepasados tenían que
comprobar si las nuevas especies eran comestibles lo que les llevaba a descubrir
en su propio cuerpo que muchas de ellos eran evidentemente comestibles; otros
venenosos y otros producían efectos un tanto diferentes: aumentaban el sudor,
les hacían defecar con mayor facilidad, les eliminaban las infecciones del trato
urinario que hasta el momento les había producido mucho malestar. Otras veces
fue simplemente el resultado de la casualidad. Así, por ejemplo, se cuenta que
un soldado español descubrió por accidente que la quina, podía curar las fiebres
intermitentes: parece ser que bebió de un charco donde había caído una rama de
este árbol y que, al despertarse, se le había curado la fiebre. Fuera como fuese
el hombre empezaba a comprender las propiedades medicinales de las plantas.
Como y por que una determinada planta tiene propiedades curativas debió ser un
misterio para aquellos pueblos primitivos, por esta razón las personas que
tuvieron un interés especial en las cualidades curativas de las plantas y que
adquirieron una cierta experiencia sobre el tema consiguieron ocupar un lugar
importante en la sociedad. Los pueblos primitivos atribuían sus efectos
curativos a la intervención de uno de sus dioses. Por esta razón, los "médicos"
primitivos quedaron asociados al conjunto de estructuras de las creencias
religiosas de los pueblos. Muchos de ellos fueron sacerdotes que actuaban como
instrumento de los dioses, de los que recibían poderes para curar.
Precisamente los primeros herbolarios fueron hombres y mujeres experimentados en
el tema de las hierbas y sus aplicaciones medicinales, culinarias, para la
preparación de tintes, perfumes y cosméticos. Finalmente durante la revolución
industrial del siglo XIX en el mundo occidental, la urbanización y la creciente
división del trabajo provocaron la desaparición gradual de esta sabiduría rural.
En la prehistoria, los humanos probablemente observando las costumbre de los
animales, empezaron a manipular las plantas medicinales (perros y gatos utilizan
la grama para purgarse; es muy frecuente encontrar tomillo en los nidos de los
insectos por su poder desinfectante). El hombre de Neanderthal ya utilizaba
plantas medicinales.
Los conocimientos sobre las plantas medicinales, antes del nacimiento de la
escritura, se realizaban oralmente.
Escherichia coli
También conocida por la abreviación de su nombre E. coli es quizás el organismo
procariota más estudiado por el ser humano, se trata de una bacteria que se
encuentra generalmente en los intestinos animales, y por ende en las aguas
negras. Fue descrita por primera vez en 1885 por Theodore von Escherich,
bacteriólogo alemán, quien la denominó Bacterium coli. Posteriormente la
taxonomía le adjudicó el nombre de Escherichia coli, en honor a su descubridor.
Ésta y otras bacterias son necesarias para el funcionamiento correcto del
proceso digestivo, además de producir las vitaminas B y K. Es un bacilo que
reacciona negativamente a la tinción de Gram (gramnegativo), es anaerobio
facultativo, móvil por flagelos peritricos (que rodean su cuerpo), no forma
esporas, es capaz de fermentar la glucosa y la lactosa y su prueba de IMVIC es
++--.
Es una bacteria utilizada frecuentemente en experimentos de genética y
biotecnología molecular. La Escherichia coli, en su hábitat natural, vive en los
intestinos de la mayor parte de los mamíferos sanos. Es el principal organismo
anaerobio facultativo del sistema digestivo. En individuos sanos, es decir, si
la bacteria no adquiere elementos genéticos que codifican factores virulentos,
la bacteria actúa como un comensal formando parte de la flora intestinal y
ayudando así a la absorción de nutrientes. En humanos, la Escherichia coli
coloniza el tracto gastrointestinal de un neonato adhiriéndose a las mucosidades
del intestino grueso en el plazo de 48 horas después de la primera comida.
La Escherichia coli puede causar infecciones intestinales y extraintestinales
generalmente graves, tales como infecciones del aparato excretor, cistitis,
meningitis, peritonitis, mastitis, septicemia y neumonía Gram-negativa.
La Escherichia coli rica está dividida por sus propiedades virulentas, pudiendo
causar diarrea en humanos y otros animales. Otras cepas causan diarreas
hemorrágicas por virtud de su agresividad, patogenicidad y toxicidad. En muchos
países ya hubo casos de muerte con esta bacteria. Generalmente le pasa a niños
entre 1 año y 8 años. Causado generalmente por la contaminación de alimentos, y
posterior mala cocción de los mismos, es decir, a temperaturas internas y
externas menores de 70 °C.
Son más comunes en mujeres por la corta longitud de la uretra (25 a 50 mm, o
bien 1 a 2 pulgadas) en comparación con los hombres (unos 20 cm, o unas 8
pulgadas). Entre los ancianos, las infecciones urinarias tienden a ser de la
misma proporción entre hombres y mujeres. Debido a que la bacteria
invariablemente entra al tracto urinario por la uretra (una infección
ascendente), los malos hábitos sanitarios pueden predisponer a una infección,
sin embargo, otros factores cobran importancia, como el embarazo, hipertrofia
benigna o maligna de próstata, y en muchos casos el evento iniciante de la
infección es desconocido. Aunque las infecciones ascendentes son las causantes
de infecciones del tracto urinario bajo y cistitis, no es necesariamente ésta la
causa de infecciones superiores como la pielonefritis, que puede tener origen
hematógeno.
El uso de antibióticos es poco eficaz y casi no se prescribe. Para la diarrea se
sugiere el consumo de abundante líquido y evitar la deshidratación. Cuando una
persona presenta diarrea no debe ir a trabajar o asistir a lugares públicos para
evitar el contagio masivo. Sin embargo en algunas patologías como la
pielonefritis hay que considerar el uso de alguna cefalosporina endovenosa. (2)
Antibiótico: Es una sustancia química producida por un ser vivo o derivada
sintética de ella que a bajas concentraciones mata o impide el crecimiento de
ciertas clases de microorganismos sensibles, generalmente bacterias. Se dice que
un antibiótico es bacteriostático si impide el crecimiento de los gérmenes, y
bactericida si los destruye.
NITROFURANTOÍNA
Nombre comercial: Furobactina.
La nitrofurantoína es un antiséptico urinario con poco o ningún efecto
antibacteriano sistémico. Es un nitrofurano sintético que tiene utilidad en el
tratamiento de infecciones del tracto urinario bajo y, de manera especial, en el
manejo de padecimientos crónicos, donde la terapia antibiótica sistémica corta
no ha logrado erradicar la infección; en estos casos puede ser de gran utilidad
la supresión prolongada de la bacteriuria.
Nombres comerciales de hidroximetilnitro-furantoína: Urfadin.
Indicaciones terapéuticas: Nitrofurantoína es un bactericida específico contra
infecciones del aparato urinario, secundarias a cepas sensibles. La
nitrofurantoína es activa contra muchas cepas de Escherichia coli y enterococos;
casi todas las especies de Proteus y Pseudomonas son resistentes, al igual que
muchas cepas de Enterobacter y Klebsiella. En clínica, la resistencia bacteriana
al fármaco surge con lentitud, siendo poco comunes las mutaciones en poblaciones
de microorganismos susceptibles, por lo que las bacterias sensibles rara vez se
tornan resistentes durante la terapéutica; no hay resistencia cruzada entre
nitrofurantoina y otros antimicrobianos. Tratamiento de infecciones del tracto
urinario bajo causadas por bacterias con sensibilidad probada al fármaco.(2,3)
Supresión de la infección crónica del tracto urinario. Es deseable usar
acidificantes de la orina para mantener un pH urinario menor de 5,5.Profilaxis
de la bacteriuria después de la prostatectomía.
Posología. En adultos para la infección de tracto urinario: la dosis usual
diaria es de 50 a 100 mg por VO, cuatro veces al día, tomadas con las comidas o
con leche; una dosis única diaria de 50 o 100 mg por VO al acostarse puede
prevenir las infecciones recurrentes.
Terapia supresiva a largo plazo: 50 a 100 mg al acostarse. En niños para la
infección de tracto urinario: 5 a 7 mg/kg/día, divididos en cuatro dosis.
Terapia supresiva a largo plazo: 1 mg/kg/día, divididos en una o dos dosis. Está
contraindicado en aquellos pacientes con hipersensibilidad a la nitrofurantoína
y a cualquier otro compuesto elaborado a base de nitrofurantoína y en pacientes
con deterioro acentuado de la función renal. Su uso está contraindicado en
pacientes embarazadas a término y en recién nacidos (menores a un mes). (3)
NETILMICINA
Nombre comercial: Netilmix.
Indicaciones terapéuticas: Infecciones intraabdominales producidas por cepas
sensibles de: E. coli, K. pneumoniae, Pseudomonas aeruginosa,
Enterobacter spp,
Proteus mirabilis, Proteus spp (indol-positivos), Staphylococcus aureus.
Neumonías e infecciones de la piel y tejidos blandos causadas por cepas
sensibles de Pseudomonas spp, Pseudomonas aeruginosa, E. coli,
K. pneumoniae,
Enterobacter spp, Proteus mirabilis, Proteus spp (indol-positivos),
Staphylococcus aureus. Septicemias producidas por Pseudomonas aeruginosa,
E. coli, K. pneumoniae, Enterobacter spp, Proteus mirabilis,
Serratia spp. y otros
bacilos gramnegativos sensibles. Infecciones urinarias complicadas, producidas
por Pseudomonas aeruginosa, E. coli, K. pneumoniae, Enterobacter spp,
Proteus
mirabilis, Proteus spp (indol-positivos), Staphyloccocus aureus,
Serratia spp,
Citrobacter spp. La netilmicina puede asociarse con la ampicilina o con
penicilina G en el tratamiento de infecciones por Streptococcus faecalis; junto
con penicilinas antiseudomonas es útil en el manejo de las infecciones por P. aeruginosa; frente a cepas multirresistentes de
Serratia spp, puede asociarse
con carbenicilina, azclocilina, mezlocilina, cefamandol, cefotaxima o latamoxef.
También podría ser útil en infecciones óseas, articulares, del tracto biliar, en
endocarditis bacteriana, meningitis (E. coli, P. aeruginosa), otitis media aguda
y sinusitis.
Posología: Adultos: (vía IM) en infecciones sistémicas graves, 1,3 a 2,2 mg/kg de
peso corporal cada 8 horas o 2 a 3,25 mg/kg de peso corporal cada 12 horas,
durante 7 a 14 días; en infecciones urinarias complicadas, 1,5 a 2mg/kg de peso
corporal cada 12 horas, durante 7 a 14 días. Niños: (vía IM) neonatos de hasta 6
semanas: 2 a 3,25mg/kg de peso corporal cada 12 horas, durante 7 a 14 días;
lactantes y niños hasta 12 años: 1,83 a 2,67 mg/kg de peso corporal cada 8 horas
o 2,75 a 4,00 mg/kg de peso corporal cada 12 horas, durante 7 a 14 días. Algunas
de las reacciones adversas son: Náuseas, vómitos, diarrea, síndrome de
malabsorción. (4)
CEFOTAXIMA
Nombres comerciales: Cefatim.
Indicaciones terapéuticas: Es un antibiótico semisintético de amplio espectro,
pertenece al grupo de las cefalosporinas de tercera generación. Cefotaxima está
indicada para el tratamiento de infecciones de huesos y articulaciones;
genitourinarias, del sistema nervioso central, del tracto respiratorio bajo; de
la piel y tejidos blandos; ginecológicos, bacteriemia y septicemia; infecciones
intraabdominales y profilaxis en intervenciones quirúrgicas con riesgo de
contaminación e infección.
Espectro antibacteriano: Cefotaxima es resistente a la mayoría de las
betalactamasas, tanto penicilinasas como cefalosporinasas; es activa in vitro,
así como en infecciones clínicas contra los siguientes microorganismos:
Aerobios grampositivos: Es activa contra Streptococcus pneumoniae,
Staphylococcus aureus productores y no productores de penicilinasas,
Streptococcus epidermidis y Streptococcus pyogens, Streptococcus agalactiae y
Enterococcus sp.
Aerobios gramnegativos: Son susceptibles Citrobacter sp, Enterobacter sp,
Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis,
Proteus vulgaris,
Proteus inconstans, Haemophilus influenzae, Haemophilus parainfluenzae,
Morganella morganii, Neisseria meningitidis, Neisseria gonorrhoeae,
Serratia sp,
Providencia rettgeri. Algunas cepas de Pseudomonas aeruginosa, Salmonella sp y
Shigella sp. Bacterias anaerobias: Cefotaxima es activa contra Clostridium sp,
Peptococcus, Peptostreptococcus, Fusobacterium. Siendo resistente
Clostridium
difficile. Especies resistentes: Streptococcus del grupo D, Listeria,
Staphylococcus meticilinorresistentes. Especies con sensibilidad inconstante:
Pseudomonas aeruginosa, Acinetobacter, Alcaligenes, Campylobacter y
Bacteroides
fragilis. Cefotaxima se encuentra contraindicada de manera absoluta en pacientes
con antecedentes o con historial de reacción alérgica a las cefalosporinas. En
paciente con antecedentes de alergia a las penicilinas, puede presentar reacción
cruzada.
Posología: Las presentaciones de Cefotaxima son para administración por vía
parenteral.
Adultos: La dosis recomendada de Cefotaxima depende del tipo de infección y la
susceptibilidad del microorganismo.
La dosis máxima diaria recomendada es de 12 g. Como guía general se recomienda
que en infecciones leves y no complicadas se administre 1 g de Cefotaxima cada
12 hrs. En infecciones de moderadas a severas, la dosis recomendada es de 1 a 2
g cada 8 horas. En infecciones que requieren dosis mayores se pueden administrar
2 g cada 6 u 8 horas; y en infecciones que ponen en peligro la vida se
recomiendan 2 g cada 4 horas. (5)
TRIMETROPRIM - SULFAMEROXAZOL
Nombre comercial: Cotrimoxazol.
Indicaciones terapeuticas: Tanto el trimetroprim como el sulfametoxazol son,
individualmente, fármacos antibacterianos eficaces de la familia de los
antagonistas del folato. Inicialmente desarrollada para el tratamiento de las
infecciones urinarias, la asociación trimetoprim-sulfametoxazol es muy versátil
y se emplea en la prevención y tratamiento de numerosas infecciones en
particular la neumonía debida al Pneumocystis carinii.
Posología: Adultos: 160 mg TMP + 800 mg de SMX por vía oral cada 12 horas
durante tres días. Este tratamiento se debe ampliar a 7 días en los pacientes
con historia de infecciones urinarias recientes, diabéticos, mujeres que
utilicen diafragma o embarazadas y personas de más de 65 años. Niños de > 2
meses: dosis de 7.5-8 mg/kg/día de TMP (37.5-40 mg/kg/día de SMX) divididas en
dos administraciones diarias cada 12 horas durante 7 a 14 días.(6)
AMPICILINA
Nombres comerciales: Posipen, y Brispen.
Indicaciones terapéuticas: Ampicilina está indicado en infecciones por gérmenes
sensibles en los siguientes casos: Infecciones respiratorias agudas altas:
otitis media, sinusitis, faringoamigdalitis. Infecciones respiratorias agudas
bajas: bronquitis, bronconeumonía, neumonía. (En coqueluche o tosferina, como
alternativa a eritromicina). Infecciones de piel y tejidos blandos, incluyendo
la prevención y tratamiento de infecciones de heridas quirúrgicas o por
mordedura. Infecciones periodontales. Infección de vías urinarias (sola o en
combinación con otro antibiótico). Infecciones gastrointestinales como
shigelosis o fiebre tifoidea. Meningitis bacteriana aguda (en combinación con
otro antibiótico). Sepsis (en combinación con otro antibiótico). Tratamiento o
prevención de la endocarditis bacteriana (sola o en combinación con otro
antibiótico). Tratamiento y prevención de infecciones después de cirugía
abdominal (sola o en combinación con otro antibiótico). Profilaxis pre-parto en
pacientes de alto riesgo de transmisión perinatal del estreptococo del grupo B.
(7)
Posología:
Adultos VO: 500 mg - 1 g cada 6 horas.
Adultos IV: 1 - 12 g/día en 4-6 dosis.
Niños VO: 50 - 200 mg/kg/día en 4 tomas.
Niños IV: 100 - 400 mg/kg/día en 4-6 dosis.
Niños: 200 mg/kg/día en 4 tomas.
CEFTRIAXONA
Nombre comercial: Acantex.
Indicaciones terapéuticas: Se utiliza en el tratamiento de infecciones graves
por bacterias gramnegativas, incluyendo septicemia, infecciones de huesos y
articulaciones, infecciones pélvicas de la mujer, infecciones intraabdominales,
neumonía, infecciones de la piel y tejidos blandos e infecciones complicadas de
las vías urinarias producidas por organismos sensibles. En infecciones del
tracto respiratorio, en especial neumonía, garganta, nariz y oídos. Para tratar
la meningitis en niños y adultos, se ha observado que la Ceftriaxona es eficaz
en dosis única. En el tratamiento de la gonorrea endocervical y uretral no
complicada y también se ha utilizado en el tratamiento de la enfermedad de Lyme.
En profilaxis de infecciones perioperatorias causadas por organismos sensibles.
Posología: Dosis Adultos y adolescentes: vía intravenosa de 1 a 2 g/día en 1 a 2
dosis, o de 500 mg a 1 g cada 12 horas. Profilaxis perioperatoria: 1
g
administrado una hora y media a 2 horas antes de la cirugía. Infecciones
gonocócicas: vía intramuscular 250 mg en dosis única. Límite en adultos: hasta 4
g /día. Dosis Pediátrica: vía intravenosa de 25 a 37.5 mg por Kilogramo de peso
cada 12 horas. En meningitis: 100 mg/kg/día o 50 mg/kg/cada 12 horas. Límite en
niños: 4 g/día en meningitis, 2 g para otras infecciones. (8)
CEFALOTINA
Nombre genérico: Klefin.
Indicaciones terapéuticas: La cefalotina está indicada en el tratamiento de las
infecciones causadas por microorganismos susceptibles. Se deben hacer estudios
de cultivos y de susceptibilidad. El tratamiento se puede instituir antes de que
se obtengan los resultados de los estudios de susceptibilidad. Infecciones del
aparato respiratorio causadas por Streptococcus pneumoniae, estafilococos
(productores y no productores de penicilinasa), Streptococcus pyogenes, especies
de Klebsiella y Haemophilus influenzae. Infecciones anaeróbicas (abscesos
pulmonares o neumonía) debidas a las especies de Peptococcus, Peptostreptococcus
y Bacteroides (el B. fragilis es relativamente resistente). Infecciones de la
piel y tejido subcutáneo, incluso peritonitis, causadas por estafilococos
(productores y no productores de penicilinasa), Streptococcus pyogenes,
Escherichia coli, Proteus mirabilis y Klebsiella.
Infecciones del aparato genitourinario causadas por Escherichia coli, Proteus
mirabilis y especies de Klebsiella. Septicemia, incluso endocarditis causada por
Streptococcus pneumoniae, estafilococos (productores y no productores de
penicilinasa), Streptococcus pyogenes, Streptococcus viridans, Escherichia coli,
Proteus mirabilis y especies de Klebsiella. Infecciones gastrointestinales
causadas por las especies Salmonella y Shigella. Meningitis causada por
Streptococcus pneumoniae, Streptococcus pyogenes, y estafilococos (productores y
no productores de penicilinasa).
Posología: En los adultos, la dosis habitual de cefalotina es de 500 mg a 1
g
cada 4 a 6 horas. Una dosis de 500 mg cada 6 horas es adecuada en casos de
neumonía sin complicaciones, furunculosis con celulitis y en la mayoría de las
infecciones del aparato urinario. En las infecciones graves, la dosis de 500 mg
puede repetirse cada 4 horas. En caso de que el paciente no responda como se
desee, aumente la dosis a 1 g. En las infecciones severas, si es necesario
pueden darse dosis de 2 g cada 4 horas. En las infecciones anaerobias, la dosis
debe ser de 2 g cada 4 horas. Para uso profiláctico perioperatorio, para
prevenir las infecciones postoperatorias en pacientes adultos sometidos a
procedimientos quirúrgicos en sitios contaminados o que se pueden contaminar, se
recomienda administrar 1 a 2 g por vía intravenosa justo antes de la
intervención quirúrgica (aproximadamente media hora a 1 hora antes de la
incisión inicial), 1 a 2 g durante la intervención quirúrgica (según la duración
del procedimiento) y 1 a 2 g cada 6 horas durante 24 horas en el postoperatorio.
Un curso más prolongado de tratamiento puede ser aconsejable en ciertos
procedimientos quirúrgicos. A los niños se les puede administrar 20 a 30 mg/kg
de peso en los momentos ya indicados. (9)
CARBENICILINA
Nombre comercial: Azapan.
Indicaciones terapeuticas: Es una penicilina semisintética (carboxifenilpenicilina)
que pertenece a la familia de las carboxipenicilinas (ticarcilina, sulbenicilina,
carfecilina, carindacilina) con un efecto bactericida selectivo sobre la flora
gramnegativa (Proteus, E. coli), enterobacterias (Klebsiella,
Enterobacter) y en
especial el bacilo piociánico (Pseudomonas aeruginosa). Infecciones graves.
Infecciones hospitalarias, quemados severos, infecciones de diferente
localización (genitourinaria, abdominal, obstétrica, ósea) por gérmenes
sensibles.
Posología: La dosis habitual oscila entre 20 y 30 gramos por día administrados
en un goteo de 1 hora de duración cada 4-6 horas. La dosis ponderal es de
400-500 mg/kg/día. En sepsis ginecológicas urinarias, aborto séptico, se puede
usar por vía IM o IV en dosis de 4 a 8 gramos por día (10)
AMIKACINA
Nombre comercial: Amikakur.
Indicaciones terapeuticas: El sulfato de Amikacina es un antibiótico de la
familia de los aminoglucósidos semisintético, derivado de la kanamicina. El
espectro de actividad antimicrobiana de Amikacina es el más amplio de los
aminoglucósidos, tiene una resistencia a la enzima que inactiva a este grupo.
Amikacina está indicada para el tratamiento de infecciones causadas por gérmenes
susceptibles como: Gramnegativos: Amikacina es activa, in vitro, en contra de
especies de Pseudomonas, Escherichia coli, Proteus (indolpositivo, indolnegativo),
Providencia sp, Klebsiella-Enterobacter-Serratia sp, Acinetobacter
(anteriormente Mima-Herellea) sp y Citrobacter freundii. Cuando las cepas de los
organismos mencionados son resistentes a otros aminoglucósidos, incluyendo
gentamicina, tobramicina y kanamicina, aún pueden ser susceptibles in vitro al
sulfato de Amikacina. Grampositivos: Amikacina es activa, in vitro, en contra de
especies de estafilococos productores y no productores de penicilinasa,
incluyendo las cepas resistentes a la meticilina. Sin embargo, en términos
generales, los aminoglucósidos presentan una menor actividad en contra de otros
organismos grampositivos: Streptococcus pyogenes, enterococos y Streptococcus
pneumoniae (anteriormente Diplococcus pneumoniae). Amikacina es resistente a la
degradación por parte de la mayoría de las enzimas inactivadoras de los
aminoglucósidos que afectan a la gentamicina, tobramicina y kanamicina. Los
estudios in vitro, demuestran que el sulfato de Amikacina, en combinación con un
antibiótico beta-lactámico, actúa en forma sinérgica en contra de muchos
organismos gramnegativos que son de importancia clínica, como Proteus rettgeri,
Providencia stuartii, Serratia marcescens o Pseudomonas aeruginosa.
Posología: Adultos: 250 mg (3.7 mg/kg), 375 mg (5 mg/kg) y 500 mg (7.5
mg/kg),
las concentraciones séricas máximas son de 12, 16 y 21 mg/ml, respectivamente.
Con función renal normal, un 91.3% de una dosis I.M. (11)
GENTAMICINA
Nombre comercial: Gentamil.
Indicaciones terapeuticas: Gentamicina es un antibiótico aminoglucósido de
amplio espectro. Actúa sobre bacterias gramnegativas aerobias, incluyendo
enterobacteriáceas, Pseudomonas y Haemophilus. Actúa también sobre estafilococos
(Staphylococcus aureus y Staphylococcus epidermidis) incluyendo cepas
productoras de penicilinasa, tiene actividad muy limitada sobre estreptococos.
Carece de actividad sobre bacterias ana-erobias. Gentamicina inyectable está
indicada en infecciones causadas por gérmenes sensibles:
Infecciones abdominales.
Infecciones de piel y tejidos blandos.
Infecciones gastrointestinales.
Infecciones biliares.
Infecciones genitourinarias que incluye infecciones complicadas y recidivantes.
Infecciones óseas.
Infecciones en quemaduras.
Otras infecciones: Meningitis, septicemia, peritonitis, listeriosis, peste,
neumonía (Klebsiella-Pseudomonas) granuloma inguinal.
Posología:
Dosis para pacientes con función renal normal IM o IV. Niños: 6 a 7,5 mg/kg/día.
(2,0 a 2,5 mg/kg administrados cada 8 horas.) Infantes y neonatos: 7,5 mg/kg/día
(2,5 mg/kg administrados cada 8 horas). Prematuros o neonatos a término de una
semana o menos: 5 mg/kg/día (2,5 mg/kg administrados cada 12 horas). Adultos: 3
mg/kg/día, administrados en tres dosis iguales cada 8 horas, en dos dosis
iguales cada 12 horas, o en una sola dosis al día. (12)
CLORANFENICOL
Nombre comercial: Abefen.
Indicaciones terapéuticas: Cloranfenicol está indicado para el tratamiento de
las infecciones externas del ojo y/o de sus anexos que afectan párpados,
conjuntiva y/o córnea, causadas por microorganismos sensibles a los componentes
de la fórmula, como: conjuntivitis, blefaritis, queratitis, queratoconjuntivitis,
blefaroconjuntivitis. Cloranfenicol es un antibiótico de amplio espectro
altamente efectivo contra la mayoría de bacterias grampositivas y gramnegativas,
así como la mayoría de anaerobios (incluyendo anaerobios obligados), Mycoplasma,
Rickettsias y espiroquetas. Cuenta con una alta eficacia (reportada de 91 a 93%
en infecciones oculares) y es activo contra más del 94% de los patógenos
oculares. También es utilizado en 55% de los casos de ojo rojo. Cloranfenicol es
útil en la profilaxis prequirúrgica y postoperatoria. Cloranfenicol, además de
su amplio espectro de actividad antibacteriana contra organismos grampositivos y
gramnegativos (tanto aerobios como anaerobios), cuenta con una buena tolerancia
en múltiples regímenes de dosificación; seguridad y efectividad como un solo
agente para el tratamiento de las infecciones oculares externas. Estudios
clínicos han demostrado que su uso en niños es seguro.
Posología: Oftálmica. Aplíquese 1 a 2 cm de Cloranfenicol Ungüento en el fondo
del saco conjuntival inferior del (los) ojo(s) afectado(s) de 3 a 5 veces al día
por los siguientes 7 a 10 días según lo valore el médico tratante. (13)
CEPA BACTERIANA
Colonia microbiana procedente de un solo germen obtenido de un enfermo, y
multiplicado por pases sucesivos en diferentes medios de cultivo.
AGAR SANGRE
Es una combinación de un agar base (agar nutritivo) con el agregado de 5 % de
sangre ovina, también puede usarse sangre humana, para cultivos en una placa de
agar. El agar sangre aporta muchos factores de enriquecimiento. Se usa también
para ver la capacidad hemolítica de los microorganismos patógenos (que es un
factor de virulencia). Observando los halos hemolíticos alrededor de las
colonias se determina el tipo de hemólisis que posee: alfa: halos verdosos beta:
halos incoloros gamma: inexistencia de halos. (14)
Fórmula en gramos por litro (g/l)
Infusión de músculo de corazón: 375.0 g/l
Peptona: 10.0 g/l
Cloruro de sodio: 5.0 g/l
Agar: 15.0 g/l
pH final: 7.3 ± 0.2
AGAR MULLER HINTON
Este medio de cultivo ha sido recomendado universalmente para la prueba de
sensibilidad a los antimicrobianos. Además es útil con el agregado de sangre
para el cultivo y aislamiento de microorganismos nutricionalmente exigentes.
(15)
Fórmula en gramos por litro (g/l)
Infusión de carne: 300.0 g/l
Peptona ácida de caseína: 17.5 g/l
Almidón: 1.5 g/l
Agar: 15.0 g/l
pH final: 7.3 ± 0.1
Instrucciones: Suspender 37 g del medio deshidratado en un litro de agua
destilada. Dejar embeber de 10 a 15 minutos. Calentar con agitación frecuente y
hervir durante 1 minuto. Esterilizar a 121 °C durante 15 minutos. Enfriar a
45°-50 °C y distribuir a cajas de Petri (o agregar los suplementos que se desee)
hasta un nivel de 4 mm sobre una superficie horizontal (25-30 ml en placas de 9
cm de diámetro).
AGAR MAC CONKEY
Este medio se utiliza para el aislamiento de bacilos Gram negativos de fácil
desarrollo, aerobios y anaerobios facultativos. Permite diferenciar bacterias
que utilizan o no, lactosa en muestras clínicas, de agua y alimentos. Todas las
especies de la familia Enterobacteriaceae desarrollan en el mismo. (16)
Fórmula en gramos por litro (g/l)
Peptona: 17.0 g/l
Pluripeptona: 3.0 g/l
Lactosa: 10.0
Mezcla de sales biliares: 1.5 g/l
Cloruro de sodio: 5.0 g/l
Agar: 13.5 g/l
Rojo neutro: 0.03 g/l
Cristal violeta: 0.001 g/l
pH final: 7.1 ± 0.2
Instrucciones: Suspender 50 g del polvo por litro de agua destilada. Reposar 5
minutos y mezclar hasta uniformar. Calentar suavemente y hervir 1 a 2 minutos
hasta disolver. Esterilizar en autoclave a 121 °C durante 15 minutos.
EXTRACTO
Es una sustancia obtenida por extracción de una parte de una materia prima, a
menudo usando un solvente como etanol o agua. Los extractos pueden
comercializarse como tinturas o en forma de polvo.
EXTRACTO HIDROALCOHOLADO
Los extractos hidroalcoholados tienen la ventaja que se les puede calcular la
dosis exactas. La planta en polvo se coloca dentro de un embudo tapado por
abajo, y se le agrega agua y alcohol al 75% hasta que quede cubierta la planta
en polvo, se deja reposar por lo menos 12 horas. Posteriormente se destapa el
embudo y se deja salir todo en un recipiente, después se le vuelve añadir agua y
alcohol hasta que la preparación quede clara, el líquido que se obtiene, se
filtra con un algodón grueso y se deja evaporar a baño maría sin que hierva.
(17)
BLANCO DE MCFARLAND
Se utiliza como patrones de turbidez en la preparación de suspensiones de
microorganismo. (18)
PAPEL FILTRO WHATMAN DE 3 cm
Condiciones de velocidad de filtración: ASTM, el tiempo necesario para que
100ml. De agua pre filtrado pasen a través de un papel de 15 cm doblado en
cuadrante.
MATERIAL
- Extractos hidroalcoholados de estafiate, quina amarilla, tomillo, eucalipto, cuachalalate.
- Discos con antibióticos de control.
- Discos con extractos hidroalcoholados.
- Frascos estériles.
- Guantes.
- Bata de laboratorio.
- Gorro y cubrebocas.
- Frascos goteros ámbar.
- Cepa de E. coli.
- Cajas petri.
- Agar sangre.
- Agar Mc Conkey.
- Agar Muller Hinton.
- Blanco de macfarland.
- Asa estéril.
- Mechero Fisher.
- Pinzas de disección.
- Clorox dual.
- Tubos de ensayo.
- Pipetas Pasteur.
- Bulbos de pipetas.
- Agua.
- Alcohol al 70%.
- Papel filtro Whatman de 3 cm.
EQUIPO
- Incubadora craft.
- Autoclave.
METODOLOGÍA
- Tipo de Estudio: Experimental, Analítico y Transversal.
- Universo: Extractos hidroalcoholados de las especies botánicas: quina amarilla, Estafiate, Tomillo, Cuachalalate y Eucalipto.
- Población: Quina amarilla, Estafiate, Eucalipto, Tomillo y Cuachalalate.
- Muestra: 5 especies botánicas, para la identificación de efecto inhibitorio en la cepa de E. coli.
- Criterios de Inclusión: Solo las especies de interés de estudio.
- Criterios de Exclusión: Aquellas especies que no interesan en el estudio.
- Criterios de Eliminación: Papel filtro impregnado con los extractos hidroalcoholados de las plantas de estudio que estén contaminados.
MATERIAL VEGETAL
ESTAFIATE
Nombre científico: Artemisia ludoviciana ssp. mexicana (willd. ex Spreng.) Keck.
ITIS-TSN: 183738.
Familia: Asteraceae.
Sinónimos latinos: Artemisia ludoviciana var. mexicana (willd. ex Spreng.) Gray;
Artemisia mexicana Willd. ex Spreng.; Artemisia neomexicana Greene ex Rydb.; y
Artemisia vulgaris var. mexicana (willd. ex Spreng.) Torr. et Gray.

Estafiate (Artemisia ludoviciana). Cuautla, Mor. Foto: Claudia Serrano Pérez, 28-02-11.
Propiedades: Antihelmíntica, antiparasitaria, antidiarreica, depurativo,
estomáquico, emenagogo, colagogo, antiespasmódico, y antirreumático.
Usos
medicinales: Para aliviar vomito, diarrea y dolor de estomago, combatir
amibiasis y parasitosis. En otros padecimientos gastrointestinales como
trastornos de la secreción, motilidad o sensibilidad gástricas que perturben la
digestión, resulta útil ya que favorece la excreción de jugos gástricos y por
efecto antiespasmódico también se emplea para controlar dolores tipo cólico en
casos de litiasis biliar.
Posología y receta. La forma más común para problemas gastrointestinales
generales es preparar una infusión para tomar, con una pulgarada de hojas
desmenuzadas, ya sean secas o verdes, esta porción es para una taza, debe
tomarse tres veces al día hasta la remisión de los síntomas, en promedio se
observan resultados en un intervalo de 7 a 15 días: para estimular el apetito
debe prepararse una infusión o cocimiento con 100 g de los tallos, de las flores
y hojas, agregándolos a un litro de agua hervida; dosificar por tazas tomando 2
poco antes de las comidas principales.
Cuidados y contraindicaciones. No debe emplearse si hay sospecha de embarazo o
sin control médico en mujeres embarazadas ya que favorece la hemorragia uterina;
a dosis excesivas puede causar desordenes metabólicos y neurotoxicidad. (19)
TOMILLO
Nombre científico: Thymus vulgaris L.
ITIS-TSN: 505501.
Familia: Lamiaceae.

Tomillo (Thymus vulgaris). Cuautla, Mor. Foto: Claudia Serrano Pérez, 28-02-11.
Usos curativos tradicionales: Digestivo, antiparásito, antihelmíntico,
anticatarral, antimicrobiano, expectorante, mucólitico. Su decocción está
indicada para la tos, resfriados, gripes, sinusitis, obstrucciones de las vías
respiratorias, bronquitis. Es recomendado para el dolor de garganta:
Administrado en gargarismos es muy efectivo en laringitis, amigdalitis y
faringitis y alivia la tos irritativa. Entre otros usos es recomendado como
desinflamatorio de las anginas. Entre los más destacados gérmenes contra los que
actúa se encuentran: Proteus, Enterococcus, Staphylococcus, Steptococcus,
Neumococcus, Alcalescens dispar y Cándida albicans. (20)
CUACHALALATE
Nombre científico: Amphipterygium adstringens (Schltdl.) Schkiede ex Standl.
Número en GRIN: 312558.
Familia: Anacardiaceae.
Sinónimos latinos: Hypopterygium adstringens Schltdl., y Juliania adstringens (Schltdl.)
Schltdl.

Cuachalalate (Amphipterygium adstringens). Cuautla, Mor. Foto: Claudia Serrano Pérez, 28-02-11.
Usos curativos: Antiinflamatorio gástrico, antibacteriano gástrico, protector de
la mucosa gástrica. Originario de México. En el cocimiento de las raíces secas,
corteza, o los tronquillos del cuachalalate al respirar el vapor se
descongestionan las vías respiratorias si presenta gripa, tuberculosis o
bronquitis. Su preparación en forma de infusión junto con el árnica actúa como
antiinflamatorio del estomago, la gastritis crónica, y ulcera gástrica.
Disminuye el dolor gástrico, limpia el estomago de la presencia de parásitos.
También cabe mencionar que tiene un efecto curativo en infecciones de vías
urinarias junto con la cola de caballo y el palo de tres costillas. (21)
QUINA AMARILLA
Nombre científico: Hintonia latiflora (Sessé et Moc. ex. DC.) Bullock,
Numero de identidad en el Missouri Botanical Garden: 27906527.
Familia: Rubiaceae.
Sinónimos latinos: Coutarea latiflora Sessé et Moc. ex DC.; Coutarea pterosperma
(S. Watson) Standl.; Hintonia latiflora var. Leiantha Bullock; Hintonia
standleyana Bullock; y Portlandia pterosperma S. Watson.
Sinónimos comunes:
La quina amarilla también se conoce como: copalchi, colpache, colpachile y
cascara sagrada.

Quina amarilla (Hintonia latiflora). Cuautla, Mor. Foto: Claudia Serrano Pérez, 28-02-11.
Propiedades: La corteza seca en cocimiento, se toma como febrífuga,
antipalúdica, antidisenterica, colagoga, antibiliosa, astringente, analgésica,
antiespasmódica y antiparasitaria. Forma de empleo y usos: su tintura se usa
como antipalúdica administrando 20 gramos diarios; su cocimiento contra la
bilis, y en fomento contra los granos; el uso actual más generalizado es para la
diabetes y para controlar las fiebres producidas por el paludismo, fiebre
tifoidea y a últimas fechas para curar el dengue.
También se emplea para afecciones del hígado. En todos los caos se recomienda
preparada en te o simplemente remojada en agua. Se puede tomas a cualquier hora,
como agua de uso. La corteza es ampliamente utilizada en el tratamiento de la
disentería, para tratar la fiebre estimular secreción biliar, como analgésico en
diferentes padecimientos,. Para lavar heridas y granos, así como también para el
tratamiento de enterocolitis.
Cuidados y contraindicaciones: No se conocen reportes de intoxicación humanas
por el uso terapéutico tradicional. Se recomienda no tomar durante el embarazo
ya que se puede ser abortiva. (22)
EUCALIPTO
Nombre científico: Eucalyptus camaldulensis Dehn.
ITIS-TSN: 502465.
Familia: Myrtaceae.
Sinónimos botánicos: Eucalyptus rostrata Schltdl., Eucalyptus X mcintyrensis
Maiden, y Eucalyptus camaldulensis var. obtusa Blakely
Sinónimos comunes: Alcanfor, árbol de la fiebre, clavos, gigante, ocalo, palo
eucalipto, ucalipto. Oaxaca: tzon tzko nasi. Puebla: ntajine (popoloca).

Eucalipto (Eucalyptus camaldulensis ). Cuautla, Mor. Foto: Claudia Serrano Pérez, 28-02-11.
El uso medicinal que se le asigna a esta planta, la indica en trastornos
respiratorios, principalmente contra la tos. Con este fin se ingiere la cocción
de las hojas, antes de acostarse por la noche, además de inhalar los vapores.
Cuando la tos es muy fuerte, se prepara junto con flores de camelia o bugambilia
morada (Bougainvillea sp.) y gordolobo (Gnaphalium attenuatum) o en vez de éste,
canela (Cinnamomum zeylanicum). Este remedio sirve además para afecciones del
pulmón, se toma caliente las veces que sea necesario. Además se utiliza en casos
de bronquitis, congestión de bronquios, ronquera y asma. En el tratamiento de
estos padecimientos, se emplean las hojas en cocimiento por vía oral. En
gárgaras se utiliza para bajar la inflamación de la garganta. Contra la gripe se
remojan las hojas en alcohol y se aplican en la frente, o se colocan las ramas
debajo de la cama y con el olor que desprenden se descongestiona la nariz. Por
otra parte, la cocción de los retoños junto con los de guayaba, limón y de
naranjo, más cáscara de guamuchil (Pithecellobium dulce), se indica para quitar la diarrea
o sólo se hierven los retoños, se agrega un poco de azúcar y se toma para
aliviar la acidez; después de la ingestión de bebidas alcohólicas.
También se recomienda para la falta de apetito, bilis, heridas, sarampión,
contra el dolor de cabeza, la fiebre y como desinfectante. (23)
OBJETIVO GENERAL
Mediante una técnica estéril elaborar extractos hidroalcoholados de las plantas
en estudio, realizando antibiogramas, empleando estas preparaciones, cada una
por separado, comparándolas con nitrofurantoina, netilmicina, cefotaxima,
trimetropim sulfameroxazol, ampicilina, ceftriaxona, carbenicilina, amikacina,
gentamicina y cloranfenicol como control en el crecimiento bacteriano.
OBJETIVOS ESPECÍFICOS
Conocer el grado de esterilidad de los extractos hidroalcoholados utilizando
la técnica de prueba de esterilidad.
Determinar la sensibilidad de las colonias de Escherichia coli mediante
extractos hidroalcoholados de las plantas medicinales (Quina amarilla,
Cuachalalate, Tomillo, Estafiate y Eucalipto), en comparación de antibiogramas
con antibióticos nitrofurantoina, netilmicina, cefotaxima, trimetropim
sulfameroxazol, ampicilina, ceftriaxona, carbenicilina, amikacina, gentamicina y
cloranfenicol.
Reportar una base de datos (tabla) en cuanto el efecto de cada una de las
plantas medicinales empleadas en el estudio.
HIPÓTESIS
El crecimiento de las colonias de Escherichia coli será inhibido por los
extractos hidroalcoholados de Quina amarilla, Cuachalalate, Tomillo, Estafiate y
Eucalipto.
DEFINICIÓN DE VARIABLES
Variable dependiente: Cepa de Escherichia coli.
Variable independiente: Sensibilidad de las cepas de Escherichia coli a los
extractos hidroalcoholados de las plantas medicinales (Quina amarilla,
Cuachalalate, Tomillo y Eucalipto).
IMPORTANCIA DEL ESTUDIO
Las infecciones urinarias en la actualidad siguen siendo un tema de importancia
médica y sobre todo para investigación, ya que se presentan en todas las
poblaciones y no importando status socioeconómico.
El mal manejo de estas infecciones presenta un alto riesgo de complicaciones
para el paciente que las padece, sobre todo si no se emplean las medidas
adecuadas para poder eliminarlas.
Comenzando desde el diagnostico, ya que desde el principio, ya que en ocasiones
no se manejan los análisis clínicos pertinentes y solamente se prescriben
antibióticos para aliviar los síntomas y por lo tanto el cuadro clínico se puede
enmascara y esto es un factor que propicia a la aparición de complicaciones. Y
el uso inapropiado de estos antibióticos puede producir una resistencia
microbiana, complicando a un mas el padecimiento del paciente.
Otro punto muy importante para considerar en estos temas es el costo de estos
los tratamientos comerciales en comparación con los preparados a base de plantas
medicinales, este ultimo resulta mas accesible para población y mas fácil de
conseguir, tomando en cuenta que existe una amplia variedad de plantas con este
efecto y también varias formas de empleo para cumplir con el tratamiento, y un
punto muy importante es que estas no van a producir alguna otra alteración en el
funcionamiento del cuerpo humano.
En la actualidad existen pocas fuentes bibliográficas sobre los efectos
curativos y específicos de estas plantas. Por todo lo anterior ya mencionado se
considera muy importante la realización de este trabajo, ya que con el se
pretende ampliar los escasos conocimientos de los efectos curativos de las
plantas para estos padecimientos muy comunes en la población de todas las
edades.
Y sobre todo para crear bases para continuar con el estudio de estas plantas
para otro tipo de bacterias y descubrir cada unas de las propiedades que estas
plantas de estudio tienen en relación con otros padecimientos.
LIMITACIONES DEL ESTUDIO
Desde la primera línea de estudio que se pretendió realizar sobre estas plantas
como tratamiento para infecciones del tracto urinario, nos dimos cuentas que era
un tema muy interesante, pero sobre todo muy enriquecido y que iba a permitir
la relación de un trabajo intermultidisciplinario. El primer punto era encontrar
el lugar para la realización del trabajo, pero sobre que el colaborador se
interesara en el tema y posteriormente se realizaran todas las pruebas
analíticas para poder presentar un buen trabajo. Durante la búsqueda del lugar
nos encontramos con limitaciones de que los químicos no tenían el tiempo para
poder atendernos y posteriormente hacíamos las citas y nos los encontrábamos,
después la otra limitación encontrada fue respecto a determinar el procedimiento
exacto y adecuado para la elaboración de los extracto hidroalcoholados, teníamos
que emplear la mejor técnica para estos fueran estériles, pero sobre todo que
perdieran las plantas de estudio sus propiedades, las cuales son el objetivo del
estudio. Posteriormente la otra limitación fueron los factores económicos, ya
que tuvimos que comprar el material necesario y específico para que los
extractos no se nos contaminaran y para poder trasladarlos al laboratorio de
estudio. Una de las limitaciones más importantes fue la localización de la cepa
de estudio.
DISEÑO DE INVESTIGACIÓN
El trabajo experimental de este estudio se realizo con el apoyo de la Q.F.B
Edith Patricia Orea Esparza y el Ingeniero Químico: José Roberto Carrasco
Villegas, previo a todo esto se busco la autorización con la química dueña del
laboratorio CEDMAA (Centro de de Diagnostico Microbiológico de Aguas y
Alimentos), para poder utilizar dicha área y el material necesario para la
realización del estudio.
Se procedió a la preparación de extractos hidroalcoholados con las plantas a
estudio, utilizando 2 técnicas diferentes, la primera sugerida por el profesor
en donde solo se utiliza la técnica indica por el profesor Mario Rojas, en donde
se deja reposar la planta y se prepara como se indica material Tlahui 6 de
plantas medicinales sin que hierva el extracto hidroalcoholado, solo se hierven
los papeles filtro y el otro en donde el extracto se pone a hervir con el papel
filtro se trabaja con material previamente esterilidad, al igual que el área
para poder trabajar. Se realiza prueba de esterilidad de dichos extractos
preparados en medios de Agar sangre. Se realizo la resiembra de una cepa de E.
coli previamente identificado por medio de la Prueba de género y especie. Se
realiza una sedimentación de la bacteria en blanco Mc Farland. Se inocula en agar
Muller Hinton y como medio selectivo Mc Conkey ambos contenían los discos de
papel filtros impregnados de los extractos hidroalcoholados de las plantas de
estudio y los discos con los antibióticos: nitrofurantoina, netilmicina,
cefotaxima, trimetropim sulfameroxazol, ampicilina, ceftriaxona, carbenicilina,
amikacina, gentamicina y cloranfenicol como control.
Lo que busco con la resiembra es observar el crecimiento o la inhibición de la
bacteria en las cajas petri con las plantas y con los antibióticos de estudio
sobre la sepa de E. coli, para de este modo poder determinar el grado de
inhibición de las plantas de estudio sobre esta cepa de estudio y así poder
realizar las comparaciones correspondientes.
INSTRUMENTOS
Biorrector de Cepa.
PROCEDIMIENTO
1.- Preparación de extractos hidroalcoholados de las plantas secas y
pulverización.
-Lavar la planta con agua purificada.
-Secar la planta al aire ambiente.
2.- Colocar 250 gramos de cada una de las plantas de estudio (Estafiate, quina
amarilla, tomillo, eucalipto y cuachalalate), en recipientes con 50 ml de agua +
150 ml de alcohol al 75%, y dejar reposar para trabajarlas al siguiente día.

Plantas en reposo con 50
ml de agua + 150 ml de alcohol al 75%, Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
3.- Se vacían los extractos hidroalcoholados a otros recipientes, y se le agrega
otros 50 ml de agua + 50 ml de alcohol al 75%.
4.- Del líquido obtenido se procede a filtrar con un algodón grueso y se deja
evaporar. Obteniendo una consistencia clara.

Filtrado de extractos, Cuautla, Mor., México. Foto: Claudia Serrano Pérez, 28-02-11.
Obtención final del extracto de cada planta por separado: tomillo, quina
amarilla, estafiate, eucalipto y cuachalalate. Cuautla, Mor. Fotos: Claudia
Serrano Pérez. 27-02-2011.
5.- Esterilizar los frascos goteros color ámbar para colocar cada uno de los
extractos hidroalcoholados obtenidos.

Frascos en proceso de esterilización, Cuautla, Mor., México. Foto: Claudia Serrano Pérez, 28-02-11.
6.-Colocar cada uno de los extractos obtenidos a baño maría.

Frascos en extractos hidroalcoholados a baño maría y obtención final del extracto listo para preparar discos. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
7.- Preparación de disco impregnado de cada uno de los extractos de las plantas
de estudio, con papel filtro de 3 cm. En donde se coloca extracto al papel
estéril.
7.1.- Se procede a elaborar 5 formas diferentes de papel filtro para poder
identificar cada una de las plantas de las cuales están impregnados.

Elaboración de discos de papel filtro de diferentes figuras. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
-Disco de forma de corazón: Cuachalalate.
-Disco en forma de triangulo: Estafiate.
-Disco en forma de círculo: Quina amarilla.
-Disco en forma de gota: Tomillo.
-Disco en forma de cuadrado: Eucalipto.
7.2.- Esterilizar cada uno de los discos. Utilizando la técnica de hervir el
extracto hidroalcoholado.

Esterilización de discos en primera técnica. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
7.3.- Realización de lavado quirúrgico de 3 tiempos, para poder manejar los
discos estériles.

Realización de lavado quirúrgico en 3 tiempos. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
7.4.- Sacar los discos de papel filtro, con técnica estéril. Colocación de
guantes estériles.

Colocación de guantes estériles y extracción de papeles estériles. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
7.5.- Impregnación de extractos hidroalcoholados, hirviendo el extracto
obtenido, y colocando los disco de papel filtro. A pesar de esterilizar los
discos de papel filtro.

Extracto en punto de ebullición para impregnación de disco con el extracto de
cada planta a estudio. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
7.6.- Colocar los discos en frascos estériles y ponerlos a baño maría para que
se evapore el resto del extracto y no queden húmedos, lo cual nos puede dar un
crecimiento positivo. Y rotularlos a cada uno.
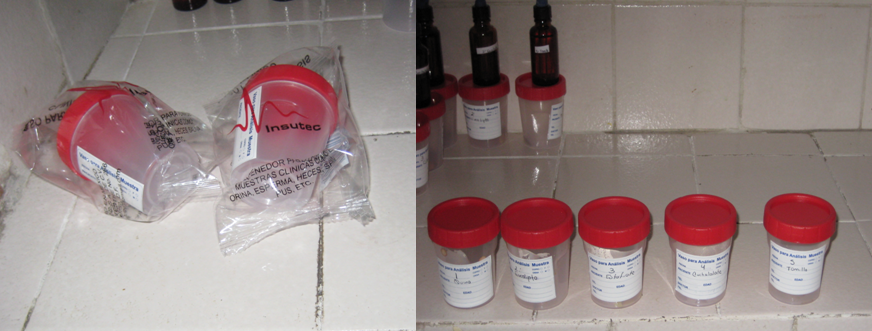
Obtención final de discos con técnica estéril, listos para realizan de prueba de
esterilidad. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
8.- Preparación de discos con extractos hidroalcoholados, hirviendo la planta y
colocando el disco hasta que el extracto hidroalcoholado se consuma.
8.1.- Colocar el 100 ml extracto hidroalcoholado a hervir junto con 250 gramos
de planta. Se hizo así con cada una de las 5 plantas de estudio.

Extracto hidroalcoholado hirviendo con 250 gramos más de la planta de estudio. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
8.2.- Agregar los disco para la impregnación del extracto hidroalcoholado a
hervir con el extracto. Hasta que se consuma todo el extracto.

Extracto hidroalcoholado más planta y los discos de papel filtro en punto de
ebullición. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez, 28-02-11.
9.- Segundo lavado quirúrgico en 3 tiempos y colocación de guantes estériles
para extraer cada uno de los discos impregnados con el extracto con la planta de
estudio.
10.- Extraer los discos cuando se haya consumido todo el extracto.
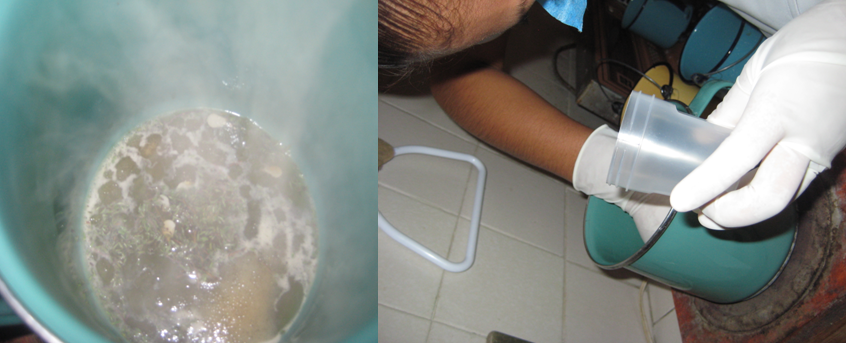
Extracción de los discos de papel filtro. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
11.- Colocar el disco impregnado del extracto en recipientes estériles y
rotularlos. Y poner a baño maría para que se sequen

Discos de papel filtro a baño maría para secarlos. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
12.- Se procede a realizar prueba de esterilidad a cada uno de los discos
impregnados de extractos, utilizando ambas técnicas.
" Primero se sanitiza el área de trabajo con clorox dual. (trietilenglicol al
5.91% alquil dimetilbenzal, amonio sacarinato al .29%, dejándolo actuar 10
minutos.

Clorox dual, para la sanitazar el ambiente. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Se prepara agar sangre y se coloca en cajas de petri.
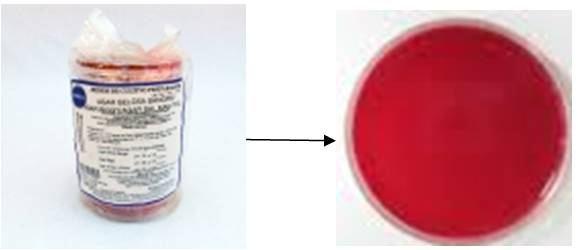
Agar sangre y medio de cultivo listo para iniciar la siembra. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Se produce a sembrar los 10 discos impregnados de los extractos de estudio, en
medio de agar sangre.

Material para iniciar la siembra. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Se coloca una caja de petri como control del medio ambiente del lugar donde se
realizó la siembra.

Caja de petri en medio ambiente como control de esterilidad. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Se colocan las cajas de petri en la incubadora craft, y se deja 24 horas para
evaluar el crecimiento.

Incubadora de Craft. Cuautla, Mor., México. Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Evaluación del crecimiento de el grado de esterilidad de los disco con
impregnación de los extractos hidroalcoholados a las 24 horas.
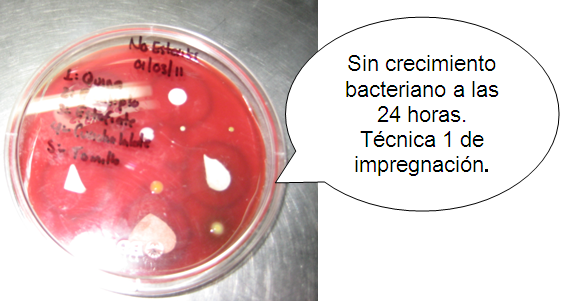
Medio de cultivo con Disco de impregnación. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
Medio de cultivo con disco de impregnación mediante técnica una en donde solo se
hierve el extracto con los discos. No hay crecimiento algo (---).
Cultivo con discos impregnados de extracto hervido. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
Medio de Cultivo con discos impregnados mediante técnica de extracto hervido mas
planta seca, hasta el que se consuma. Sí hubo un crecimiento en discos de Quina
Amarilla y Tomillo.
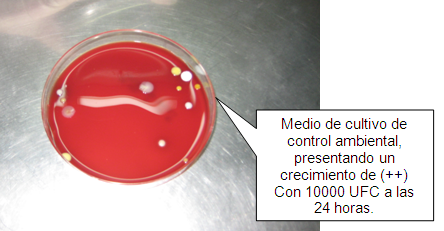
Medio de cultivo de control ambiental, con un crecimiento bacteriano de (++) a las 24 horas. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
" Se procede a la evaluación del crecimiento a las 72 horas.
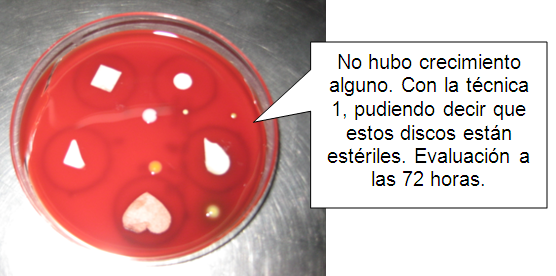
Medio de cultivo con discos impregnados estériles. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez. 05-03-2011.
Medio de cultivo con discos impregnados mediante la técnica 1, comprobando que
están estériles. Sin crecimiento, ni desarrollo de algún halo.
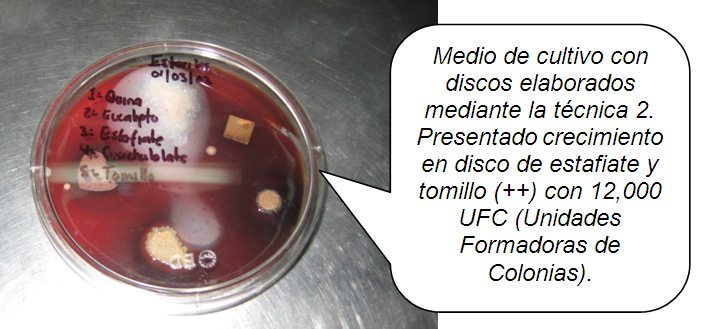
Crecimiento bacteriano en discos de impregnación. Cuautla, Mor., México.
Foto: Claudia Serrano Pérez. 05-03-2011.
Crecimiento bacteriano en discos de impregnación mediante técnica 2.
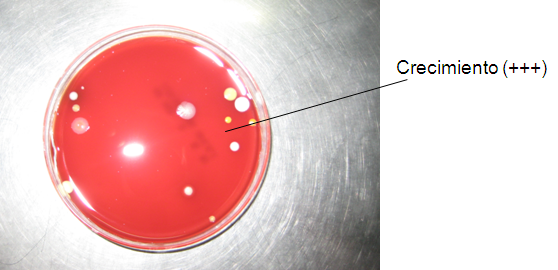
Crecimiento bacteriano en medio de control ambiental. Cuautla, Mor., México.
Foto: Claudia serrano Pérez. 05-03-2011.
Crecimiento bacteriano de (+++) en medio de control ambiental a las 72 horas.
10.- Se realiza prueba de género y especie de la cepa de E. coli. Pudiendo
identificar que realmente esta cepa era de E. coli.
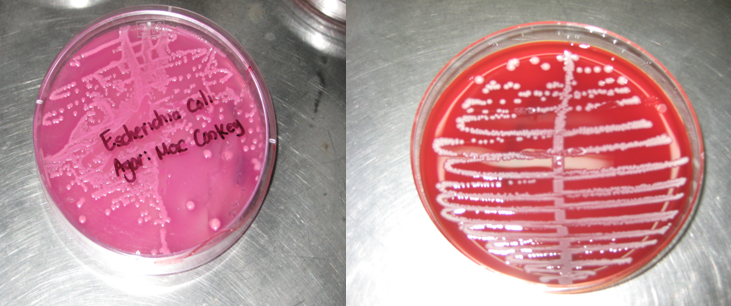
Cepa de E. coli, presentando crecimiento en Agar Sangre y Mac Cookey. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 01-03-2011.
11.- Se procede a preparar las suspensiones de la cepa de e. coli con blanco de
Macfarland.

Suspensión de E. coli en Blanco de Macfarland. Cuautla, Mor., México.
Foto: María
Esperanza Martínez Espinosa. 07-03-2011.
12.- Se siembra de forma estriado y con el asa bacteriológica la cepa de E. coli
preparada en suspensión de blanco de Macfarland, en Agar Muller Hinton.

Sembrado de E. coli en Agar Muller Hilton. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 07-03-2011.
13.- Se colocan los discos elaborados con la técnica 1 y los discos de
Cuachalalate, Quina amarilla y Eucalipto de la técnica 2.
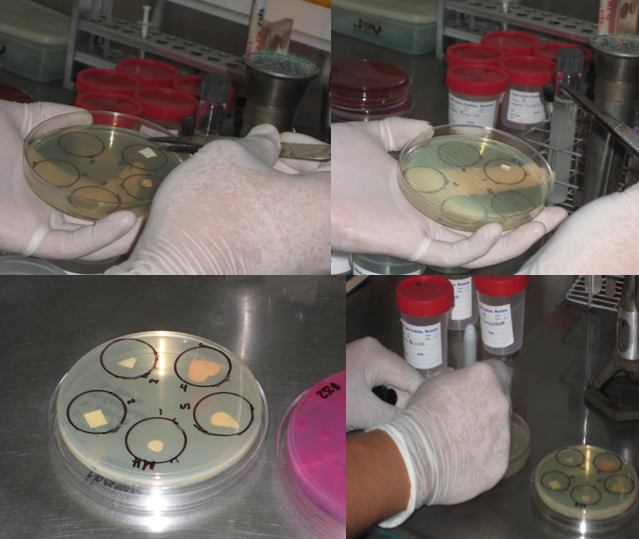
Colocación de discos impregnados con extractos hidroalcoholados. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 07-03-2011.

Siembra de discos de Quina Amarilla, Eucalipto y Cuachalalate de técnica 2. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 07-03-2011.
14.- Se colocan las cajas petri en la incubadora de Craft para la incubación y
se revisa el crecimiento las 24 horas.

Incubación de Discos de impregnación con cepa. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 07-03-2011.
15.- Se procede a sembrar los discos de control con cada uno de los
medicamentos. Nitrofurantoina, Netilmicina, Cefotaxima, trimetropim
sulfameroxazol, Ampicilina, Ceftriaxona, Carbenicilina, Amikacina, Gentamicina y
Cloranfenicol
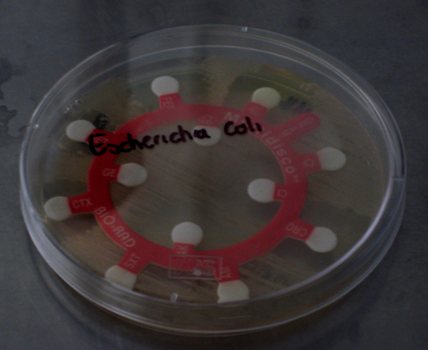
Discos de control. Cuautla, Mor., México. Foto: María Esperanza Martínez Espinosa. 07-03-2011.
16.- Evaluación a las 24 horas del crecimiento bacteriano y efecto inhibitorio
de los discos impregnados de extractos hidroalcoholados.
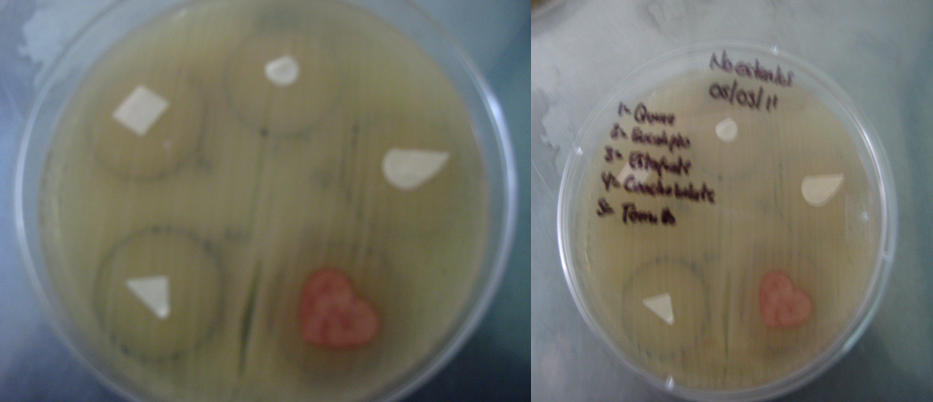
Medio de cultivo con discos impregnados, técnica 1. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 08-03-2011.
Medio de cultivo con discos impregnados de las plantas de estudio mediante la
técnica 1. Observando un crecimiento bacteriano de (+).

Medio de cultivo con discos impregnados, técnica 2. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 08-03-2011.
Medio de cultivo con discos impregnados de las plantas de estudio mediante la
técnica 2. Observando un crecimiento bacteriano de (+) y cambios de coloración.

Inhibición del crecimiento bacteriano en los discos de control. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 08-03-2011.
Evaluación del crecimiento bacteriano a las 72 horas.
Crecimiento bacteriano en cajas con discos impregnados. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 10-03-2011.
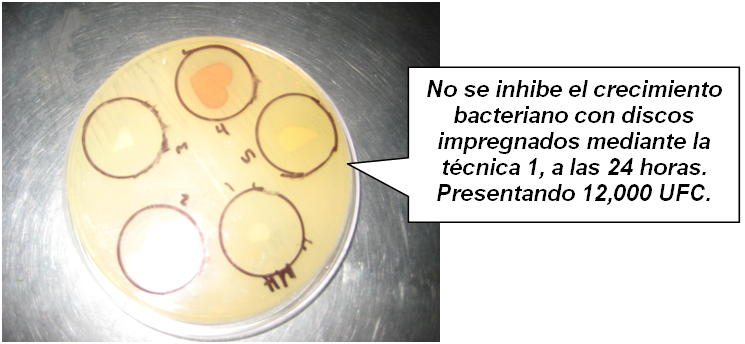
Crecimiento bacteriano de (++) de 12,000 UFC, con discos impregnados con los
extractos hidroalcoholados, elaborados con la técnica 1.
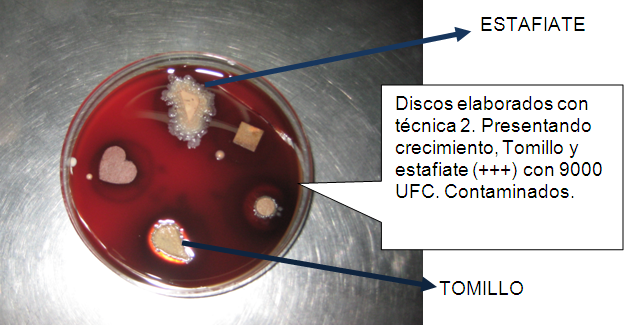
Discos de técnica 2, con cambios de coloración. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 10-03-2011.
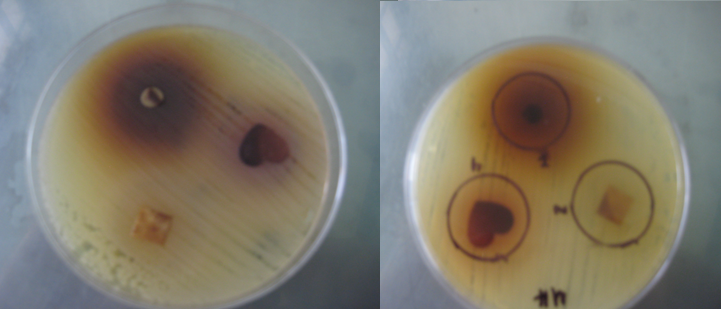
Discos elaborados con la técnica 2, en donde solo se observa cambios de
coloración Y 12,000 UFC.
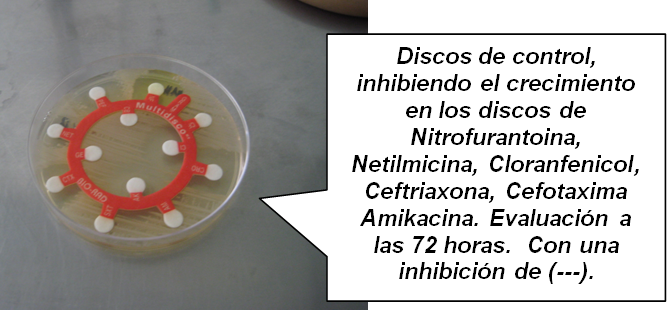
Discos de control con antibióticos. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 10-03-2011.

Laboratorio en donde se realizo el estudio de investigación. Cuautla, Mor., México.
Foto: María Esperanza Martínez Espinosa. 10-03-2011.
RESULTADOS
|
PLANTAS DE ESTUDIO |
RESISTENCIA |
SUSCEPTIBLE |
|
CUACHALALATE |
X |
Se
observan cambios de coloración. |
|
ESTAFIATE |
X |
|
|
EUCALIPTO |
X |
Se
observan cambios de coloración. |
|
QUINA
AMARILLA |
X |
Se
observan cambios de coloración. |
|
TOMILLO |
X |
|
|
ANTIBIÓTICOS |
RESISTENCIA |
SUSCEPTIBLE |
|
AMIKACINA |
|
XXX |
|
AMPICILINA |
|
XXX |
|
CARBENICILINA |
|
XXX |
|
CEFOTAXIMA |
|
XXX |
|
CEFTRIAXONA |
|
XXX |
|
CLORANFENICOL |
|
XXX |
|
GENTAMICINA |
|
XXX |
|
NETILMICINA |
|
XXX |
|
NITROFURANTOINA |
|
XXX |
|
TRIMETROPIM SULFAMEROXAZOL |
|
XXX |
Los resultados obtenidos de esta investigación, no fueron los esperados ya que
las plantas a estudiar no inhibieron a la cepa de Escherichia coli en un tiempo
de observación de 72 horas; pero son satisfactorios por que una vez más se
comprueba que estas plantas no tienen un efecto primario contra esta bacteria ya
que a esta investigación la anteceden otras pruebas con diferentes técnicas de
trabajo. Aunado a esto se presentan los antibióticos a los que la bacteria es
resistente y susceptible.
DISCUSIÓN
Los resultados demostraron un efecto positivo inhibitorio en la actividad
microbiana de la cepa de E. coli, en las cajas peltri en donde se colocaron los
antibióticos de control (nitrofurantoina, netilmicina, cefotaxima, trimetropim
sulfameroxazol, ampicilina, ceftriaxona, carbenicilina, amikacina, gentamicina y
cloranfenicol), pero comparándola con el efecto de las plantas de interés del
estudio (estafiate, quina amarilla, eucalipto, tomillo y cuachalalate), estas
presentaron un efecto negativo en la inhibición antibacteriana sobre la cepa,
por lo tanto podemos que a pesar de utilizar las técnicas de asepsia y
antisepsia adecuadas en la elaboración de los extractos hidroalcoholados y en la
impregnación de los discos de papel filtro, no fue suficiente para poder tener
un efecto de inhibición, por lo tanto no podemos afirmar la actividad
antimicrobiana de estas plantas.
Es de suma importancia conocer cuáles son los efectos benéficos que tienen las
plantas medicinales para los seres humanos porque es un gran avance, pero lo
primero que se tiene que conocer de las plantas son las propiedades y con esto
no se quiere decir que no haya información documentada sobre las mismas si no
que falta saber más a fondo; por ejemplo:
-Donde encontramos mayor concentración de la sustancia activa de la planta en
las hojas, corteza o raíz.
-Todo lo que les favorece y perjudica al momento de trabajarlas ya que se hace
uso de temperaturas elevadas, sustancias, tiempo de exposición, etc., porque
todo esto puede disminuir o inhibir las propiedades de las plantas.
CONCLUSIONES
El resultado obtenido en este trabajo de investigación no fue exitoso, a pesar
de que se contaron con las instalaciones, el material y el equipo necesario para
poder desarrollar todos los procedimientos de una manera más fácil y en óptimas
condiciones.
Pero algo muy importante de esta investigación es que se implementaron dos
técnicas, una sugerida por el profesor y la otra implementada por nosotros,
encontrando así que la técnica recomendado por el profesor, en cuanto a la
impregnación de los discos de papel filtro de whatman con los extractos
hidroalcoholados, en la prueba de esterilidad, estos salieron que fueron 100%
estériles, pero a pesar de todo esto, no se pudo identificar el grado de
inhibición de crecimiento bacteriano que tienen cada una de las plantas de
estudio.
De esta manera consideramos que el existen dos puntos clave para llegar a la
solución de este trabajo: el primero que el grado de concentración de la planta
en los extractos hidroalcoholados no fue el suficiente para que pudiera tener un
efecto antimicrobiano y el segundo punto es que esta especies botánicas no
tengan ningún efecto apropiado sobre la cepa de E. coli.
Sin embargo puede ser que durante las manipulaciones de la planta para poder
obtener los extractos hidroalcoholados, pudo perder sus propiedades curativas.
PROBLEMAS QUE DEJA PENDIENTES LA INVESTIGACIÓN
Poder identificar cada uno de las propiedades de la planta y cual es la mejor
técnica para que esta no las pierdan o por lo menos las conserven a un grado que
su efecto sirva para inhibición del crecimiento bacteriano para alguna cepa
patógena. Sin embargo es importante descubrir o averiguar cuál es la
concentración de los extractos hidroalcoholados que deben contener de la planta
para que sirva como antimicrobiano.
Bibliografía
[1].- Struthers, J.K. / Westran, Bacteriología Clínica Tomo II, Número 58, Capitulo 17. Cultivos y Agar, Editorial Latino Americana. México, Df, 2008, p. 1025.
[2].- Low, Royston. Compendio de medicina alternativa. Tomo I, Capitulo 2. Historia de la medicina tradicional en el mundo. Editorial Sirio, España 1990, p. 32.
[3].- Surcari i, Laura. Microbiología Y Procedimientos Bacteriologico. Tomo III. Numero 102, Capitulo 5. Gram Negativas, Editorial Panamericana. México, Df. 2009, p. 2056.
[4].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Nitrofurantoina. Editorial Thompson. México Df. 2002, p. 165.
[5].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Cefotaxima. Editorial Thompson. México Df. 2002, p. 250.
[6].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Trimetroprim - Sulfameroxazol Editorial Thompson. México Df. 2002, p. 650.
[7].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Ampicilina. Editorial Thompson. México Df. 2002. P.550.
[8]. Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades .Ceftriaxona Editorial Thompson. México Df. 2002, p. 1020
[9].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Cefalotina. Editorial Thompson. México Df. 2002, p. 1050
[10].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Carbenicilina. Editorial Thompson. México Df. 2002, p. 1920
[11].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Amikacina. Editorial Thompson. México Df. 2002, p. 350
[12].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Gentamicina. Editorial Thompson. México Df. 2002, p. 450
[13].- Faich G.A. Congress Clínica de Cress Diccionario de Especialidades Farmacéuticas. Tomo I. Medicamentos de Especialidades. Cloranfenicol. Editorial Thompson. México Df. 2002, p. 560
[14].- Aguirre, Salazar, Ray. Investigación y Experimental, Clínica de Bacteriología, Tomo II. Agar. Editorial Panamericana. México Df. 2005. P 106.
[15].- Caludis Sertarano. Diccionarios de especialidades médicas y de laboratorio experimental. Tomo III, Cultivos específicos. Editorial Sircan. Uruguay. 2006, p 56.
[16].- Struthers, J.K. / Westran. Bacteriología Clínica Tomo II, Número 58, Capitulo 18. Cultivos y Agar, Editorial Latino Americana. México, Df, 2008, p. 405.
[17].- Agustín López Gonzales. Experimentos de Medicina Tradicional. Tomo I. Numero 25, Capitulo 01. Preparaciones de tinturas, Editorial Unions de Paraguay. México Df. 2010, p. 580.
[18].- Struthers, J.K. / Westran. Bacteriología Clínica Tomo II, Número 58, Capitulo 18. Cultivos y Agar, Editorial Latino Americana. México, Df, 2008, p. 405.
[19].- Libro de planta medicinales. URL: http://www.irestoscana.it/info/salud/medicinales/libro_de_planta_medicinales.php.
[20].- Libro de planta medicinales. Ibídem.
[21].- Libro de planta medicinales. Ibídem.
[22].- Libro de planta medicinales. Ibídem.
[23].- Libro de planta medicinales. Ibídem.
Comparte esta nota en las redes sociales
 Curso de Etnomedicina y Herbolaria Mexicana Curso de Etnomedicina y Herbolaria Mexicana
 Mexican Ethnomedicine and Herbalist Course Mexican Ethnomedicine and Herbalist Course
 Cours d'ethnomédecine et phytothérapie mexicaine Cours d'ethnomédecine et phytothérapie mexicaine
 Diplomado en Medicina Tradicional de México y sus Plantas Medicinales Diplomado en Medicina Tradicional de México y sus Plantas Medicinales
 Diplomado en Temazcalli de México Diplomado en Temazcalli de México
 Diplomado en Acupuntura y Medicina Tradicional de China Diplomado en Acupuntura y Medicina Tradicional de China
 Masaje Mexicano y Reflexoterapia Masaje Mexicano y Reflexoterapia
 Náhuatl moderno-clásico Náhuatl moderno-clásico
 Búsqueda en Ciencias de la Salud Búsqueda en Ciencias de la Salud
 Regresar a Tlahui-Medic No. 32 Regresar a Tlahui-Medic No. 32
 Go back to Tlahui-Medic No. 32 Go back to Tlahui-Medic No. 32
 Retourner à Tlahui-Medic No. 32 Retourner à Tlahui-Medic No. 32
 Tlahui Medic 32, desde el 19 de agosto del 2012 Tlahui Medic 32, desde el 19 de agosto del 2012
 Consultadas a Tlahui desde el 6 de Marzo, 1996 Consultadas a Tlahui desde el 6 de Marzo, 1996
|











































